Nel regno della fantascienza, parti del corpo elettroniche sono vecchio cappello. Ma per gli esseri umani in carne ed ossa, i progressi in questo campo stanno rapidamente alterando le prospettive per il trattamento avanzato scompenso cardiaco. Anche se le innovazioni nella terapia farmacologica hanno trasformato il corso di insufficienza cardiaca precoce e moderata, la forma avanzata della malattia è rimasto un problema medico ostinato. Tuttavia, la stessa tecnologia elettronica del 21 ° secolo che ci porta sempre più telefoni cellulari compatti e lettori musicali più piccolo viene sfruttato per produrre una serie di piccoli, più leggeri, ei dispositivi più sofisticati per aiutare il cuore malato. Vanno dalla dimensione di un mazzo di carte per un paio di chili, queste macchine in miniatura sono in grado di replicare molte delle funzioni elettriche e meccaniche del cuore naturale.
Ventricolare dispositivo di assistenza
Un cuore artificiale? Non proprio, ma la nuova generazione di dispositivi di assistenza ventricolare (VAD) si sta dirigendo in quella direzione. Un VAD è una pompa a batteria impiantato nel torace per sostenere l'azione di pompaggio di uno o entrambi i ventricoli. I creatori dei primi VAD nel 1970 hanno visto questi dispositivi come una potenziale alternativa a lungo termine per trapianto di cuore. Questa visione è solo ora in corso di realizzazione. Nel frattempo, VAD si sono assicurati un posto importante in altri aspetti della cura cardiaca.
Il primo utilizzo di un VAD è stato come un recupero bridge-to-, per aiutare il cuore di una persona a riprendersi dopo un attacco di cuore o altre lesioni cardiache. VADs progressivamente assunto un ruolo di secondo come bridge-to-trapianto - una misura provvisoria per mantenere in vita un candidato trapianto fino a un donatore era disponibile. L'eccitazione corrente su VAD, però, si concentra sulla loro crescente applicazione come un'opzione di trattamento prolungato per le persone con stadio terminale insufficienza cardiaca, chiamato terapia destinazione. Una prova di riferimento, pubblicato sul New England Journal of Medicine nel 2001, è stato il primo studio a dimostrare che, rispetto alle forme esistenti di terapia medica, VAD ventricolo sinistro potrebbero offrire migliori possibilità di sopravvivenza per le persone con insufficienza cardiaca allo stadio terminale che weren ' t candidati per il trapianto. Sulla base di questi risultati, la ricerca continua spera di meglio indirizzare i pazienti che possono trarre beneficio dalla procedura. Il dispositivo si sta evolvendo pure. VADs più recenti sono più piccole e operano con una azione di pompaggio più sofisticato rispetto ai modelli precedenti (vedi Figura 9).
Nonostante la promessa offerta dal VAD, il tasso di successo nella vita reale è modesto. Infezioni e altre complicazioni gravi possono derivare da impianto. A causa di questi rischi, VAD sono attualmente considerati solo per le persone gravemente malati che hanno già gravemente compromessi cuori. Per quanto le prospettive di sopravvivenza a lungo termine con un VAD continua a illuminare, può essere ragionevole offrire questa tecnologia ad un più ampio spettro di persone.
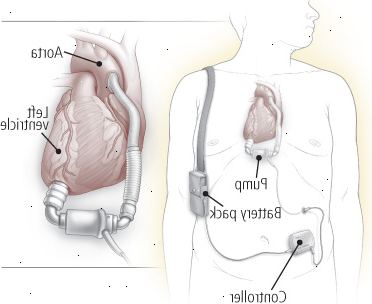
Figura 9: dispositivo di assistenza ventricolare (VAD)
Un dispositivo di assistenza ventricolare (VAD) aiuta indebolito sangue pompa ventricolo. Più supportano il ventricolo sinistro e sono noti come LVADs, ricevono sangue dal ventricolo sinistro e consegnarlo all'aorta, come mostrato sopra. Diritto di assistenza ventricolare (RVADs) ricevono il sangue dal ventricolo destro e fornire al dell'arteria polmonare. VADs costituiti da una pompa, un sistema di controllo, e una scorta di energia. La pompa può essere posizionato all'interno o all'esterno del corpo, mentre il sistema di controllo e di fornitura di energia sono fuori del corpo. |
Cuore totalmente artificiale
Una pompa meccanica autonomo che può assumere per il cuore a tempo indeterminato è stato un sogno di inventori medici per la parte migliore di una generazione. A differenza di un VAD che sostiene l'azione del ventricolo sinistro o destro, un cuore artificiale sostituisce la funzione di entrambi i ventricoli e viene impiantato in luogo del cuore naturale, che viene eliminato durante la procedura.
Forse il più noto primo tentativo di un cuore totalmente artificiale è stato il Jarvik-7, introdotto nel 1982. Questo dispositivo costituito da una pompa ad aria che azionato da una console di alimentazione esterna. L'erede moderno al Jarvik-7, il CardioWest temporaneo Cuore Artificiale Totale, è approvato dalla FDA per l'uso come un trapianto bridge-to-per le persone che soffrono di insufficienza cardiaca biventricolare.
Un altro ingresso in campo è la sostituzione Cuore AbioCor impiantabile. Questo dispositivo è costituito da una pompa 2 libbre impiantato nel torace e un regolatore e batteria interna che sono posti nell'addome. La batteria può essere ricaricata attraverso la pelle da una fonte di alimentazione esterna. Questo permette al paziente di muoversi libera da fili per un massimo di due ore alla volta, diventando così il cuore artificiale solo completamente autonomo. Il AbioCor ha assicurato l'approvazione limitata per l'uso in persone che non sono eleggibili per il trapianto di cuore e che hanno meno di un mese da vivere altrimenti.
Defibrillatore cardioverter impiantabile
Il corso naturale di insufficienza cardiaca è una delle due finali. Un individuo può finalmente morire da un problema chiamato guasto alla pompa, quando il cuore diventa così debole che non pompa. L'altro scenario frequente è la morte cardiaca improvvisa a causa di un battito cardiaco irregolare o veloce selvaggiamente nel ventricolo, con contrazioni del cuore inefficaci. Una volta che questo ritmo anormale prende piede, l'unico modo per correggerlo è con la somministrazione di una scarica elettrica al muscolo cardiaco di scioccare di nuovo in un ritmo normale. Solo cinque su 100 persone che hanno uno di questi episodi sopravvivere abbastanza a lungo per raggiungere l'ospedale.
Cuore aritmie sono prevalenti tra le persone con insufficienza cardiaca. Danno del muscolo cardiaco, soprattutto a seguito di un attacco di cuore, può interferire con le vie di conduzione elettrica attraverso il muscolo. Il problema è aggravato dal fatto che la maggior parte dei farmaci abitualmente utilizzati per stabilizzare ritmi irregolari anche diminuire la forza delle contrazioni del cuore, un effetto collaterale incompatibile per le persone i cui cuori sono già deboli.
Nel 1980, i medici hanno testato un concetto rivoluzionario - un dispositivo in miniatura impiantato nel torace che avrebbe senso un ritmo anormale e fornire subito una scossa elettrica (vedi figura 10). Questo è stato il primo defibrillatore cardioverter impiantabile (ICD). Da allora, le unità sono diventati più piccoli, più complessa e più potenza efficiente, portando a loro uso diffuso.
Molti studi clinici hanno valutato come ICD alzano contro terapia farmacologica tradizionale in una varietà di popolazioni. Uno studio ha valutato degno di nota le prestazioni di ICD nei pazienti che avevano avuto un attacco di cuore e aveva una bassa frazione di eiezione del ventricolo sinistro - un indicatore per l'insufficienza cardiaca. Il tasso di mortalità tra le persone assegnate al gruppo ICD è stato inferiore del 31% rispetto al gruppo trattato con terapia farmacologica. Questo risultato è stato così straordinariamente positivo che gli investigatori arrestarono lo studio in anticipo. Inoltre, i partecipanti di entrambi i gruppi ricevevano una terapia ottimale farmaci per l'insufficienza cardiaca, dimostrando che l'ICD ha prodotto benefici rispetto a quelli derivati da farmaco. Il lato negativo, le persone che hanno un ICD lamentano che può essere doloroso quando i fuochi del dispositivo. Essi descrivono la sensazione come una scossa improvvisa simile ad essere preso a calci nel petto.
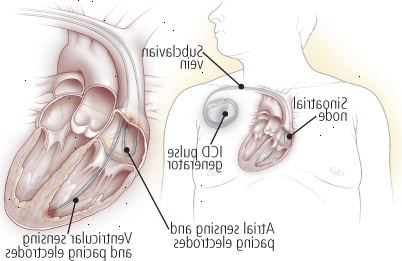
Figura 10: defibrillatori cardiaci impiantabili
Un defibrillatore cardiaco impiantabile (ICD) rileva, ritmi cardiaci potenzialmente mortali anomale e corregge il ritmo difettoso automaticamente. Per l'inserimento, che viene fatto in anestesia locale, il chirurgo inserisce elettrodi nel cuore del paziente attraverso una delle grandi vene del torace. Dopo aver testato il posizionamento degli elettrodi, un piccolo generatore viene posizionato sottocute nel torace. Se e quando il dispositivo rileva un ritmo anormale, l'ICD ripristina il normale ritmo del cuore, sia fornendo una scossa al muscolo cardiaco o utilizzando segnali a bassa energia ripetute (stimolazione cardiaca). Il dispositivo registra anche quando i ritmi anormali e quando gli shock sono somministrati. |
Terapia di resincronizzazione cardiaca
Le persone con insufficienza cardiaca avanzata a volte subiscono danni alle loro cellule di conduzione elettrica che provoca un battito cardiaco lento. Queste anomalie mostrano schemi come distintivi su tracciati ECG e possono essere corretti con un pacemaker uno derivazioni standard o un dispositivo dual-piombo che stimola sia l'atrio destro e il ventricolo destro. Tuttavia, l'evidenza suggerisce che queste tecniche non sono efficaci nelle persone con insufficienza cardiaca sistolica che hanno un ventricolo sinistro mal di pompaggio. Nel normale battito del cuore in due fasi, contrae il lato sinistro una frazione di secondo più tardi rispetto alla destra. Stimolando solo il lato destro del cuore interrompe la coordinazione naturale dei due sistemi di pompaggio, una malattia chiamata dissincronia ventricolare. Questo problema può essere superato con l'aggiunta di un terzo filo al dispositivo che stimola il ventricolo sinistro. La stimolazione è fasata in modo che il ventricolo sinistro riceve il segnale a contrarre leggero ritardo rispetto alla destra. Questa tecnica è chiamata terapia di resincronizzazione cardiaca (CRT) o pacing biventricolare.
Uno studio assegnato in modo casuale 813 persone con moderata a grave insufficienza cardiaca per ottenere CRT e terapia medica o la sola terapia medica. Coloro che hanno ricevuto CRT avevano un minor rischio di ospedalizzazione o di morte per qualsiasi causa rispetto al farmaco solo gruppo.
Un'altra osservazione interessante dalla valutazione di questi dispositivi è che CRT può effettivamente invertire alcuni dei danni ventricolare nelle persone con insufficienza cardiaca. Le modifiche delle dimensioni delle camere di pompaggio, meno riflusso di sangue attraverso la valvola mitrale, e la riduzione di spessore della parete del ventricolo sinistro tutti forniscono la prova di un muscolo cardiaco forte. Circa il 20% e il 40% delle persone con insufficienza cardiaca Stadio C potrebbero essere candidati per questa terapia.
Risincronizzazione cardiaca con ICD
Anche se i risultati degli studi iniziali della terapia di risincronizzazione cardiaca sono stati incoraggianti, i ricercatori hanno notato una omissione importante. Il tasso di mortalità di morte cardiaca improvvisa è rimasta la stessa o migliorato solo leggermente. Dal momento che molte persone con insufficienza cardiaca sono soggette sia al rallentamento del battito cardiaco e il ventricolo sinistro aritmie, il concetto di combinare le due funzioni in un unico dispositivo è stato covato. Uno studio che ha valutato il dispositivo combinato ha mostrato miglioramenti nel tasso di morte cardiaca improvvisa. Quando accoppiato con informazioni provenienti da altri studi che hanno valutato l'efficacia di ICD, i vantaggi sono notevoli.
Monitor emodinamici impiantabili
Out-of-control accumulo di liquido è il fallimento complicazione cardiaca che più spesso manda la gente in ospedale. In questo momento, il miglior modo gli individui possono misurare i loro livelli del fluido è quello di pesarsi tutti i giorni. Ma il sangue inizia ad accumularsi nel cuore e aumentare la pressione all'interno dei ventricoli lungo prima che il peso del corpo di una persona cambia notevolmente. Avere accesso a queste informazioni potrebbe consentire a un medico di adottare misure per risolvere il problema prima che si trasformi in una crisi. Diversi dispositivi attualmente in fase di sviluppo sono progettati per fare proprio questo.
In un tale dispositivo, un monitor emodinamico impiantabile è posto sotto la pelle del petto in una procedura simile a un inserimento pacemaker. Un cavo di rilevamento della pressione collega il monitor alla atrio destro. Le misurazioni vengono memorizzate nel monitor fino a quando non vengono scaricati e trasmessi elettronicamente a un sito centrale.
In uno studio di 274 pazienti trattati con il dispositivo, il totale di giorni di degenza sono diminuite del 21% su un periodo di sei mesi. Le persone con NYHA di classe III insufficienza cardiaca sono andato meglio rispetto a quelli con classe IV. Anche se l'esito dei punti di ricerca in una direzione positiva, i risultati non erano statisticamente significativi. Ciò ha indotto l'FDA circolatorio Periferiche di sistema Pannello di votare marzo 2007 contro l'approvazione del dispositivo per la vendita. Il produttore spera di migliorare i risultati e rilasciare il monitor in futuro.
Trapianto di cuore
Una volta considerata rischiosa e sperimentale, il trapianto di cuore è oggi considerato il trattamento di scelta per molte persone con grave insufficienza cardiaca. Il destinatario del primo trapianto di cuore umano, eseguita nel 1967, è sopravvissuto per soli 18 giorni. Da allora, i progressi in farmaci, tecniche chirurgiche, e la selezione dei donatori hanno portato a notevoli passi avanti nel campo. Dai primi anni 1980, il tasso di sopravvivenza a un anno a seguito di un trapianto di cuore è salito da sotto il 70% a circa il 85% a partire dal 2006. E circa il 70% dei pazienti sottoposti a trapianto di cuore sopravvivere cinque anni.
Il più grande passo avanti nel successo del trapianto è venuto nel 1983 con l'introduzione della ciclosporina. Questo farmaco potente sopprime il sistema immunitario, impedendo così rigetto dei tessuti, una delle principali complicazioni a seguito di un trapianto d'organo. Farmaci simili sono ormai standard nelle cure post-trapianto. Inoltre, i medici hanno imparato come identificare e trattare meglio altri principali rischi dopo il trapianto, comprese le infezioni che risulta dalla strozzatura del sistema immunitario e malattie vascolari che si sviluppa a volte in arterie che alimentano il cuore del donatore.
Un'altra tecnologia emergente ha il potenziale per migliorare ulteriormente i tassi di successo del trapianto. Un programma pilota in corso a cinque principali centri di trapianto sta valutando un sistema che mantiene il cuore in uno Stato funzionante come è trasportata dal donatore al ricevente. Poiché il cuore continua pulsante, la fornitura di sangue e ossigeno al organo rimane costante. Questo può potenzialmente limitare danni ai tessuti durante il tempo che il cuore è fuori del corpo e in definitiva ridurre il rischio di rigetto una volta reimpiantato. Più di 2.000 trapianti di cuore vengono eseguite ogni anno in Europa. Tuttavia, ci sono molti meno i cuori dei donatori che ci sono candidati ammissibili. Almeno il doppio di molte persone potrebbero beneficiare della procedura se più organi erano disponibili.